OBJETIVOS
1. Interpretar las leyes que rigen a los gases ideales, teniendo en cuenta las variables de estado.
2. Estudiar y comprobar estas leyes
INTRODUCCIÓN
Los gases se empezaron a estudiar desde la antigüedad por el hombre, es como así han surgido algunas relaciones que involucran variables macroscópicas como la cantidad, la presión y la temperatura para explicar el comportamiento de los gases. La relación entre la temperatura y el volumen se conoce como la ley de Charles y la relación entre la cantidad y el volumen se le conoce como ley de Avogadro. Usando estas dos relaciones mas la ley de Boyle se puede deducir una relación generalizada que involucre todas las variables y de allí surge la ecuación de los gases ideales en donde las proporcionalidades se vuelven igualdades al incluir una constante conocida como la constante universal de los gases.
MARCO TEÓRICO
¿Que es?
El gas es un término químico que se refiere a estado de agregación de la materia, el cual carece de forma y volumen, esto se debe a la manera como está compuesto, ya que está integrado por moléculas que no se encuentran unidas, propagadas y con una mínima fuerza de atracción entre ellas, acogiendo la forma y el volumen del envase que lo contiene. Debido a que las moléculas que constituyen el gas no son atraídas unas por otras, estas pueden desplazarse en el vacío en forma separada y muy rápidamente, expresando así sus propiedades.

Las partículas de un gas son totalmente libres, por lo que pueden propagarse por todo el espacio en donde están encerrados. También pueden ocupar todo el espacio del recipiente que lo contiene, no tienen determinada forma y pueden comprimirse sin esfuerzo.
Leyes
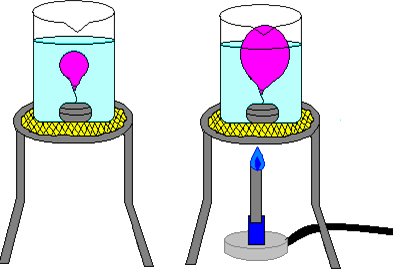
Ley de Charles
La Ley de Charles es una ley de los gases que relaciona el volumen y la temperatura de una cierta cantidad de gas a presión constante.
En 1787 Charles descubrió que el volumen del gas a presión constante es directamente proporcional a su temperatura absoluta (en grados Kelvin): V = k · T (k es una constante).
En 1787 Charles descubrió que el volumen del gas a presión constante es directamente proporcional a su temperatura absoluta (en grados Kelvin): V = k · T (k es una constante).
- Si la temperatura aumenta el volumen aumenta
- Si la temperatura disminuye el volumen disminuye

Ejemplo
Un gas ocupa un volumen de 5,5 litros a una temperatura de -193 ºC. Si la presión permanece constante, calcular a qué temperatura en volumen sería de 7,5 litros.
- Solución: ya que relacionamos temperatura con volumen a presión constante, aplicamos la Ley de Charles:V1 / T1 = V2 / T2, donde:Despejamos la incógnita T2 :
- T1 = -193ºC → 273 + (-193) = 80 ºK
- V1 = 5,5 litros, V2 = 7,5 litros
- V1 / T1 = V2 / T2 → T2 = V2 / (V1 / T1 )
- T2 = 7,5 / (5,5 / 80) = 109,1 ºK
Ley de Boyle
La Ley de Boyle es una ley de los gases que relaciona el volumen y la presión de una cierta cantidad de gas a temperatura constante.
En 1662 Boyle descubrió que la presión que ejerce un gas es inversamente proporcional a su volumen a temperatura y cantidad de gas constante: P = k / V → P · V = k (k es una constante).
Por lo tanto: P1 · V1 = P2 · V2En 1662 Boyle descubrió que la presión que ejerce un gas es inversamente proporcional a su volumen a temperatura y cantidad de gas constante: P = k / V → P · V = k (k es una constante).
- Si la presión aumenta el volumen disminuye
- Si la presión disminuye el volumen aumenta

Nota: también se le llama Ley de Boyle-Mariotte ya que este último la descubrió de forma independiente en 1676.
Ejemplo
Un globo de helio ocupa 100 litros a nivel del mar (1 atmósfera). Calcular el volumen del globo a 20 kilómetros de altura donde la presión del aire es de 0,054 atmósferas. Se considera que la temperatura es la misma en los dos puntos.
Solución:- Como se mantiene la temperatura constante podemos aplicar la Ley de Boyle
P1· V1 = P2 · V2
- Los datos que tenemos son:
- P1 = 1 atm.
- P2 = 0.054 atm.
- V1 = 100 litros
- Aplicamos la Ley de Boyle despejando la incógnita (V2):
P1· V1 = P2 · V2 → V2 = (P1/P2) · V1 = (1 atm. / 0,054 atm.) · 100 litros = 1851 litros
- V2= 1851 litros
Ley de los Gases Ideales
Los gases ideales poseen las siguientes propiedades:
- Las moléculas del gas se mueven a grandes velocidades de forma lineal pero desordenada
- La velocidad de las moléculas del gas es proporcional a su temperatura absoluta
- Las moléculas del gas ejercen presión sostenida sobre las paredes del recipiente que lo contiene
- Los choques entre las moléculas del gas son elásticas por lo que no pierden energía cinética
- La atracción / repulsión entre las moléculas del gas es despreciable
P · V = n · R · T

Donde P es la presión (en atmósferas), V el volumen (en litros), n son los moles del gas, R la constante universal de los gases ideales (0,0821 l·atm·K-1·mol-1) y T la temperatura absoluta (en grados Kelvin).
Ejemplo
Calcular el volumen de 6,4 moles de un gas a 210ºC sometido a 3 atmósferas de presión. Solución:
- Estamos relacionando moles de gas, presión, temperatura y volumen por lo que debemos emplear la ecuación P · V = n · R · T
- Pasamos la temperatura a Kelvin: 210ºC = (210 + 273) ºK = 483ºK
- V = n · R · T / P = 6,4 moles · 0,0821 · 483ºK / 3 atm. = 84,56 litros
Ahora encontraremos la definición de cada uno de los conceptos que integran las diferentes formulas
Presion
La presión de un gas se origina por el choque de sus moléculas con las paredes del recipiente que lo contiene. Cuanto más moléculas choquen mayor será la presión y cuanto más rápido se muevan (que es lo mismo que estar a mayor temperatura), mayor será la presión.
A continuación puedes ver el comportamiento de dos gases. Observa que la presión sólo cambia si modificas la temperatura del gas (las moléculas se mueven más deprisa) o si aumentas el número de moléculas (se producen más choques). Si aumentas la masa de las moléculas, la presión no cambia, ya que las moléculas se mueven más lentamente.

Volumen
Es el espacio ocupado por un cuerpo.
Temperatura
Es una medida de la intensidad del calor, y el calor a su vez es una forma de energía que podemos medir en unidades de calorías. Cuando un cuerpo caliente se coloca en contacto con uno frío, el calor fluye del cuerpo caliente al cuerpo frío.
La temperatura de un gas es proporcional a la energía cinética media de las moléculas del gas. A mayor energía cinética mayor temperatura y viceversa.
La temperatura de los gases se expresa en grados kelvin.

ACTIVIDAD
Ley de los Gases Ideales
Ley de Charles




