ESTEQUIOMETRIA, REACTIVO LIMITANTE Y PORCENTAJE DE RENDIMIENTO
Introduccion
La parte de la química que se encarga del estudio cuantitativo de los reactivos y productos que participan en una reacción se llama estequiometría. La palabra estequiometría deriva de dos palabras griegas: stoicheion, que significa elemento, y metron que significa medida.
En en el dia de hoy en este blog nos referiremos principalmente a los diferentes reactivos que existen en la química y a la vez se va a tratar el tema de la estequiometría que los reactivos anteriormente mencionados son una parte directa de la misma.
Objetivos
+ Tener en cuenta la estructura de la estequiometría, su contenido y procedimientos
+ Tener en cuenta el concepto y lograr diferenciar a los reactivos
Marco Teórico
+ Estequiometria
La palabra estequiometría deriva de dos palabras griegas: stoicheion, que significa elemento, y metron que significa medida.
La cantidad de reactivos y productos que participan en una reacción química se puede expresar en unidades de masa, de volumen o de cantidad de sustancia. Sin embargo, para hacer cálculos en una reacción química es más conveniente utilizar la cantidad de sustancia.
Los coeficientes estequiométricos obtenidos al balancear la ecuación química, nos permiten conocer la cantidad de productos a partir de cierta cantidad de reactivos, o viceversa. Para poder trabajar con la ecuación química, definimos las relaciones estequiométricas o factores de conversión que expresan un parámetro constante y universal para cada par de participantes en la reacción. Estas relaciones se obtienen a partir de la ecuación química balanceada y se fundamentan, lógicamente, en la ley de las proporciones definidas.
Ejemplo
Una forma de eliminar el CO2 del aire de una nave espacial consiste en hacer reaccionar dicho gas con NaOH:
CO2(g) + NaOH(s) → Na2CO3(s) + H2O
Se estima que en 24 horas, un astronauta exhala aproximadamente 1000 g de CO2. ¿Cuántos kilogramos de NaOH se requieren para eliminar el CO2 exhalado por el astronauta? ¿Cuántos kg de Na2CO3 se producen en el proceso?
Ecuación química balanceada:
CO2 + 2NaOH → Na2CO3 + H2O
1 mol 2mol 1 mol 1 mol
44.0 g 2(40.0 g) 106 g 18 g
Relaciones estequiométricas en masa


Relaciones estequiométricas en mol




+ Reactivo limitante
Cuando en la realidad se llevan a cabo reacciones químicas, es normal que los reactivos no se encuentran en cantidades estequiométricas, es decir, en las proporciones exactas que indican los coeficientes estequiométricos de la ecuación química balanceada. Usualmente, uno o varios de los reactivos están en mayor cantidad de la que se requiere, por lo que, al finalizar la reacción, quedará un remanente de esos reactivos.
El reactivo límite o limitante es aquel reactivo que en una reacción química se consume en primera medida, determinando la cantidad de producto o de productos obtenidos. La reacción depende del reactivo limitante, ya que según la ley de las proporciones definidas, los demás reactivos no reaccionarán cuando uno se haya consumido.
Ejemplo
Considerar la siguiente reacción:
MnO2 + 4HCl → MnCl2 + Cl2 + 2 H2O
Al inicio se ponen a reaccionar 4.5 g de MnO2 con 4.0 g de HCl. ¿Cuántos gramos de Cl2 se obtienen? Calcular la cantidad de reactivo en exceso que queda sin reaccionar.
MnO2 + 4HCL → MnCl2 + Cl2 + 2 H2O
1 mol 4 mol 1 mol 1 mol 2 mol

Para determinar cuál es el reactivo límite, se dividen las mol de cada reactivo entre el respectivo coeficiente estequiométrico. El menor valor obtenido para este cociente corresponde al reactivo límite:
Todos los cálculos estequiométricos deben hacerse tomando como referencia al reactivo límite:


+ Rendimiento teórico, rendimiento real y porcentaje de rendimiento de una reacción
Se puede pensar que una reacción química progresa hasta que se agota totalmente el reactivo limitante, sin embargo en la realidad esto no sucede siempre ni en todos los casos, por múltiples razones
Unas de las razones son:
-Existe la posibilidad de que no toda la materia prima reaccione
-Es posible que existan reacciones laterales que no lleven al producto deseado o que no pueda recuperarse totalmente el producto formado, lo cual ocasiona una merma en la producción
Con lo anterior se han establecido las nociones de rendimiento:
Rendimiento teórico
-Cantidad de producto que debiera formarse si todo el reactivo limitante se consumiera en la reacción
Rendimiento real
-Cantidad de producto efectivamente formado en una reacción
Al analizar estos rendimientos, conduce a una desigualdad, puesto que en la práctica, el rendimiento real es igual o menor al rendimiento teórico

Al traducirlo a una fórmula, se puede encontrar el porcentaje de rendimiento de una reacción
Cabe mencionar que los investigadores trabajan frecuentemente modificando todas las variables de temperatura, presión, concentración, catalizadores, etc., para llevar a los procesos del rendimiento real hasta el rendimiento teórico en la medida de lo posible
Ejemplo
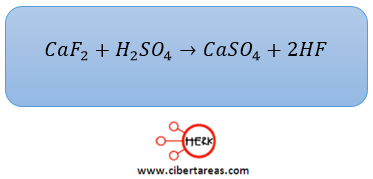
-Se preparó sulfato de calcio al hacer reaccionar 200 g de fluoruro de calcio con la cantidad adecuada de ácido sulfúrico
-Es necesario calcular el rendimiento porcentual si se obtuvieron 200 g de sulfato de calcio
Solución
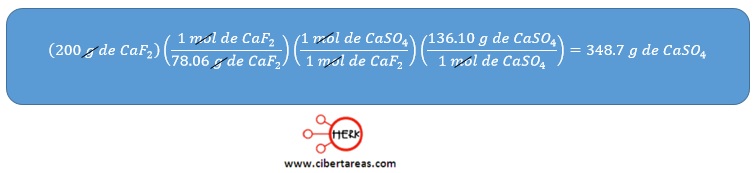
-Se necesita calcular en primera instancia el rendimiento teórico, mediante la determinación de los gramos de CASO4 que se pueden formar
El rendimiento teórico es de 348.7 g de CASO4, y como solamente se obtuvieron 200 g, el porcentaje de rendimiento se calcula así:
Actividades